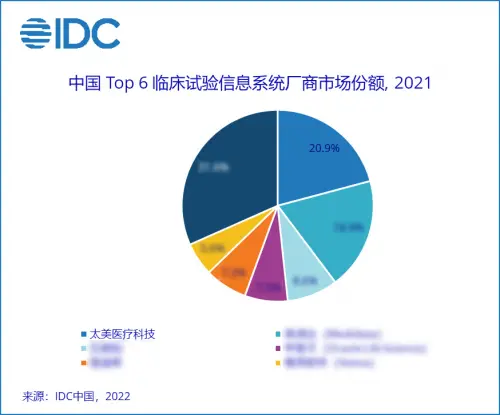
近日,IDC发布《中国临床试验信息系统解决方案市场份额,2021:快速推广普及》行业报告,该报告对于中国临床试验信息系统解决方案的市场份额及竞争态势进行了分析。数据显示,2021年太美医疗科技以20.9%的市场份额在中国临床试验信息系统领域位居第一,展现出强劲的市场竞争力与发展前景。
近年来,伴随医药创新浪潮,中国药物临床试验机构数量、临床试验数量、医药创新成果等均出现快速增长,以临床试验为例,国家药监局药品评审中心发布的最新数据显示:2021年,中国登记临床试验总量首次突破3000项,较2020年增长29.1%。;然而与此同时,集采、监管升级、创新药竞争激烈等一系列因素也使得药物临床试验领域的降本增效需求更为迫切。
一场数字化变革在临床研究领域迅速展开。
以电子数据采集系统(EDC)为例,2015年之前,中国注册临床研究使用EDC的比例仅有约30%,而2020年这一比例已快速上升至70%-80%,时至今日,基本所有注册临床研究均使用EDC系统,临床试验的信息化水平与试验质量均出显著提升。与此同时,临床试验项目管理系统(CTMS)、临床研究电子文档管理系统(eTMF)等数字化软件的使用比例也出现显著提升。然而,在开发了完整的覆盖申办方和机构的SaaS产品的同时,太美医疗科技也意识到,临床研究是一个涉及多方、复杂的协作过程,监管严格,对于规范、质量、可靠性有着极为严格的要求,以单点需求为核心的数字化软件有助于解决单方痛点,但信息和流程依旧割裂,资源严重分布不均,行业整体效率并未得到显著改善。
2019年,太美医疗科技推出TrialOS医药研发协作平台,以“协作”为核心理念,连接制药企业、医院、CRO/SMO等第三方服务商、监管机构和患者,统一SaaS产品登录入口,统一标准,形成各产品间的数据交互与流转,平台化技术实现各方流程上的在线协作,透明完整的行业信息展示与整合,使得临床试验资源得以优化配置,有效提升临床试验整体质效。特别是在面对突发事件之际,高度的线上协作能力,可以帮助临床试验正常开展,为新药研发保驾护航。
至今,TrialOS已为1100余家医药企业/CRO、660+家临床试验机构提供数字化解决方案,在2018-到2021年间,支持了约40%的国家一类新药的研发上市,每年约15%~20%的不良反应报告通过TrialOS递交至国家药品不良反应监测中心,且已对接34个国家/地区监管机构的相关数据库。
深耕国内市场的同时,太美医疗科技也开始了海外市场的开拓。
近日,太美医疗科技宣布为东南亚知名CRO企业 —— CSI Medical Research提供的eArchives(eTMF)临床研究电子文档管理系统和eCooperate(CTMS)临床试验项目管理系统正式上线启用,为提升其临床运营管理效率和质量持续发挥作用。此前双方已就数字化临床研究的多个领域达成合作协议。
医药创新浪潮仍将澎湃,太美医疗科技也将持续携手全球合作伙伴,为“全球新”加油!
本文网址:http://hqshangbao.com/xinwen/46403.html
声明:本站原创/投稿文章所有权归环球商报所有,转载务必注明来源;文章仅代表原作者观点,不代表环球商报立场;如有侵权、违规,可直接反馈本站,我们将会作删除处理。